
Schrodinger Suites 2018-1 win/linux/mac三版本
附带安装教程- 软件大小:17285 MB
- 更新日期:2020-04-06 14:16
- 软件语言:简体中文
- 软件类别:辅助设计
- 软件授权:免费版
- 软件官网:待审核
- 适用平台:WinXP, Win7, Win8, Win10, WinAll
- 软件厂商:

软件介绍 人气软件 下载地址
Schrodinger 2018-1是一款药物设计和材料科学软件,能够为生命科学和材料研究提供软件解决方案和服务,该程序内置了数十个功能模块,并且所有功能模块都可以协同工作;小分子药物发现套件和材料科学拥有大量的新功能和改进,基于规则的方法和基于QM的方法的pKa预测都得到了改进,共价配体对接已添加,其中包括各种常见的对接化学,改进了对接中的pi堆栈交互;分子动力学已更新,现在包括对GPU加速的支持;QM工具已经更新,界面也得到了改进;ADME工具已更新,尤其是P450代谢位点的准确性有所提高,可在多种化学系统上应用的预测能力,包括,反应热化学和反应路径探索,过渡态理论的反应和传输速率常数,用于计算氧化和还原电势的验证模型,精确的形成热和雾化能对于大型系统,含过渡金属的系统具有可靠的性能,与电场有关的性能的有效计算,复杂系统的振动和电子光谱的预测,多种预定义的计算模式代表了平衡速度和精度的测试模拟参数;PYMOL也进行了更新,改进了渲染速度,并修复了一些错误;需要的用户可以下载体验
新版功能
一、Maestro图形界面
通过改进的属性树,轻松控制项目表中的显示属性[2018-1]
在收藏夹工具栏中编辑标题[2018-1]
交互调整环形构造[2018-1]
查找核心Maestro功能,例如作为任务工具[2018-1]中的Surface和Hydrogen Bond面板
支持Mac触控板手势,包括缩放和Z轴旋转[2018-1]
可选择禁用预测高亮显示[2018-1]
控制超出选定范围的网格范围计算PB静电表面的原子数[2018-1]
可选择指定原子标签的小数精度[2018-1] - 包括[2018-1]的几个新学院教程
二、FEP +
可选择指定界面[2018-1]中的自定义热区域。单独控制受体和配体原子。快速查看显示溶剂和复杂腿部的热原子
检查共价结合蛋白质
配体系统的边缘分析[2018-1]
报告配体健康评估中与水分子的空间冲突[2018-1]
将FEP +结果输出到Excel用于进一步分析的工作簿[2018-1]
将FEP +结果导入LiveDesign [2018-1]
添加到文档中的新学院教程[2018-1] 三、分子动力学
改进的膜松弛协议[2018-1]
四、AutoQSAR
轻松构建和应用深度学习模式使用我们的基于TensorFlow的DeepChem集成[2018-1]。适用于对大型数据集进行建模,可处理数十万种化合物
五、工作流和流水线
包括最新版本的KNIME(v3.5)[2018-1]
New Bioisoster更换节点[2018-1]
Maestro中KNIME工作流程支持的新快速表单节点[2018-1]
抗体构建的新工作流程示例和序列转换器[2018-1]
改进了Windows上许多面板的响应速度[2018-1]
提高了2D渲染器的速度[2018-1]
软件特色
Schrodinger 2018-1提供致力于解决药物研究中挑战的完整软件套装,
包括小分子药物发现套件,生物学套件,材料科学套件,DISCOVERY INFORMATICS SUITE,PYMOL,其功能不一样。
小分子药物发现套件:这是一套全面的套件,可加速潜在客户的发现和优化;
生物学套件可以所有对建模生物制剂,抗体和蛋白质都很重要的工具;
材料科学套件可以用于计算化学系统的结构,反应性和性质的多种工具;
DISCOVERY INFORMATICS SUITE允许实时在整个发现团队中进行数据共享和协作设计;
PYMOL可以生成令人惊叹的高性能分子图形用于沟通结构性结果。
安装步骤
1、用户可以点击本网站提供的下载路径下载得到对应的程序安装包

2、只需要使用解压功能将压缩包打开,双击主程序即可进行安装,弹出程序安装界面
3、可以根据自己的需要点击浏览按钮将应用程序的安装路径进行更改
4、弹出以下界面,用户可以直接使用鼠标点击下一步按钮
5、现在准备安装主程序,点击安装按钮开始安装
6、现在准备安装主程序,点击安装按钮开始安装
7、弹出应用程序安装进度条加载界面,只需要等待加载完成即可
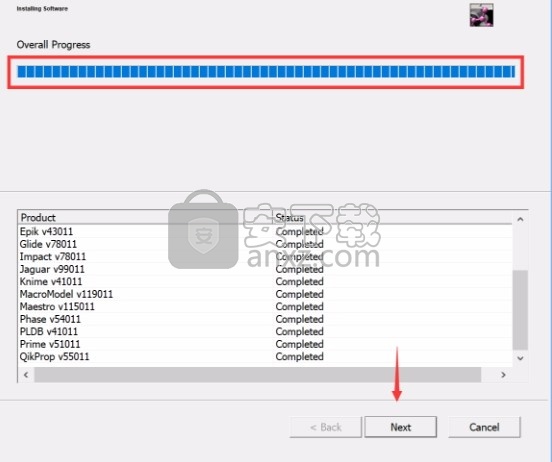
8、根据提示点击安装,弹出程序安装完成界面,点击完成按钮即可
方法
1、程序安装完成后,先不要运行程序,打开安装包,将patcher文件夹内的patcher.exe复制到安装目录(默认:C:\Program Files\Schrodinger2018-1)
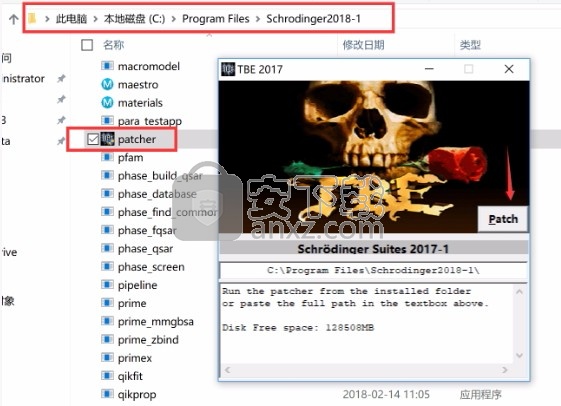
2、然后在程序安装路径下运行注册机,弹出对应的界面后,点patch完成
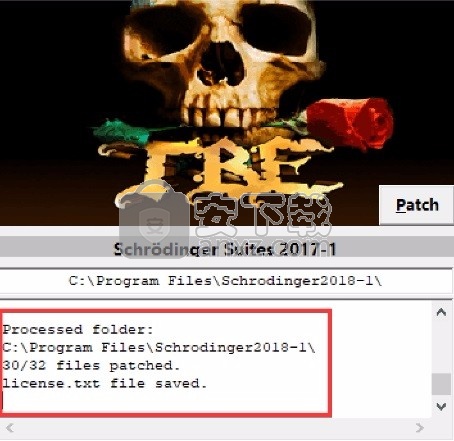
3、点开始菜单,这么多软件都可以免费使用了
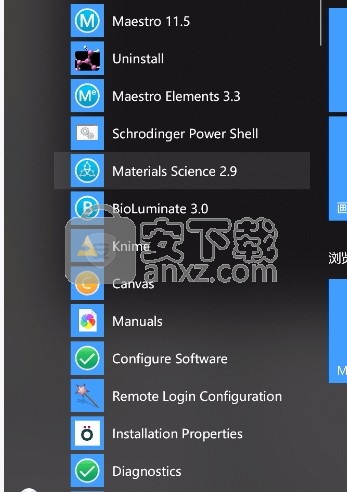
4、完成以上操作步骤后,就可以双击应用程序将其打开,此时您就可以得到对应程序

使用说明
大规模的体外功能测试和通过蛋白质建模的新颖变异评分为洞悉低磷症的碱性磷酸酶活性提供了见识
抽象低磷血症(HPP)是一种罕见的代谢紊乱,其特征在于低组织非特异性碱性磷酸酶(TNSALP),通常由ALPL基因突变引起。HPP是异质性的,临床表现与残余TNSALP活性和/或显性负作用(DNE)相关。我们通过瞬时转染和TNSALP酶活性测量,测量了155个ALPL变体的残余活性和DNE 。九十个变体显示出低残留活性,而二十四个显示出DNE。这些结果涵盖了基因组聚合数据库中载频高于1 / 25,000的所有错义变体。我们将所得数据作为参考,以开发一种对ALPL进行评分的新计算算法错义变体,并预测TNSALP高/低酶活性。我们的方法使用基于物理学的隐式溶剂能量模型来测量氨基酸变化对TNSALP二聚体稳定性的影响。我们以高特异性预测突变有害性,达到0.63的真阳性率和0的假阳性率,且受体工作曲线下的面积(AUC)为0.9,比所有测试的计算机预测指标都好。将此算法与其他计算机方法结合使用,可以进一步提高性能,达到0.94的AUC。这项研究扩展了我们对HPP异质性和基因型/表型关系的理解,旨在改善临床ALPL变异体的解释。
低磷血症(HPP)是一种罕见的,系统性,遗传性,代谢性疾病,其特征在于碱性磷酸酶(ALP)的酶活性低,通常由组织非特异性碱性磷酸酶(TNSALP)基因的致病性变异引起,HPP是一种临床上的异质性疾病,其表现范围包括出生时严重的骨骼矿物质不足,癫痫发作和呼吸系统疾病之后主要发生复发性骨折,疼痛,肌肉无力和功能受限从历史上看,HPP已根据出现骨骼疾病或其他重大并发症的年龄分为不同的临床形式:围产期,产前良性,婴儿期,儿童期,成人和Odonto-HPP。围产期和婴儿期HPP通常被认为是最严重的形式,并且与高死亡率相关,尤其是在使用酶替代疗法之前。尽管这些分类有助于描述疾病,但HPP的临床表现和严重程度在患者之间可能存在很大差异,无论该疾病的形式如何,甚至在给定形式的疾病中也是如此
HPP的临床变异性很大程度上是其ALPL遗传异质性的结果。迄今为止,已鉴定出390多种致病变体,其中大多数是错义变体,错义ALPL变体可以影响表达,折叠,修改,贩卖,和TNSALP蛋白的二聚化,从而导致残留的酶活性的不同水平,此外,ALPL变异体可能表现出显性负效应(DNE),这可能是由于突变型和野生型(WT)单体之间的负相互作用或由于突变型蛋白对WT蛋白的隔离,从而阻止了其转运至膜,一些证据表明HPP的临床表现与突变蛋白的体外酶活性和/或DNE的强度,但是,残留的酶活性和DNE仅在报告的HPP变体的一小部分中已知
本研究有两个具体目标,其首要目标是通过(a)扩大在体外具有残余酶活性特征的ALPL变体的库,以及(b)使用体外数据来提高对ALPL基因型/表型关系的理解。开发新颖的计算方法来检测特定变体的低残留酶活性的存在与否。
材料和方法
编辑政策和道德考量
对包括在该分析中的患者进行了测试以用于诊断目的,并根据赫尔辛基宣言的宗旨设计了该研究。所有患者和/或其父母均获得了知情同意书,以进行ALPL变体筛选和HPP相关基因测试。所有患者均具有明显的欧洲,中东或日本血统。
ALPL变量选择
为了扩展当前经过功能测试的ALPL变体的目录,选择了155个变体并对其进行了优先排序,以代表一般人群数据库和HPP患者中的那些(请参阅支持信息材料中的详细信息)。基因型数据来自于345例经确诊为HPP诊断的患者的回顾性历史队列,这些患者在1997年至2016年期间在法国国立宪法医院(Pénataleet Postnatale)进行了基因检测(前身为SESEP实验室;法国勒谢内尔凡尔赛中心医院)。
从基因组聚合数据库,HPP患者队列和其他来源收集了其他错义,移码,框内插入缺失和无义ALPL变体。 在支持性信息材料中)。在一起,变体的组合集包括等位基因频率> 1 / 25,000的所有非同义外显子gnomAD ALPL变体,以及罕见患者和人群变体的随机样本。
质粒制备,转染和TNSALP活性测定
有关质粒制备,转染和TNSALP活性测定的完整详细信息,请参见支持信息材料。简而言之,用100%的突变质粒或对应于突变质粒:WT质粒的混合物(比率50:50)瞬时转染MDCK II细胞。通过将在405 nm处测得的TNSALP吸光度除以在405 nm处测得的β-半乳糖苷酶吸光度来确定归一化TNSALP值。将纯突变体和共转染的WT:突变体数据计算为三次转染的平均值,并表示为在同一平板上转染的纯WT质粒的百分比。
预测患者基因型的体外活性
为了 通过基因型(即纯合,杂合和复合杂合)预测历史HPP队列(n = 345)中患者变体的体外活性,估计TNSALP残余活性并将其表示为每位患者的WT活性的一部分如下:
对纯合患者的估计活性是测得的突变体体外活性。如果患者没有经过体外测试的变异体,但在计算上预测其变异体会完全丧失功能(LoF;即无意义,剪接或移码变异体),则假定他们的TNSALP残余活性会为空。
对于杂合患者的估计活性是50/50共转染混合物的体外活性测量值。对于具有单一杂合LoF变异体且未测得TNSALP残留活性的患者,假设LoF等位基因不会表达任何蛋白质,则估计TNSALP残留活性为0.5。
对于复合杂合患者,如果两个等位基因都没有DNE(定义为从突变体/ WT混合物中测得的相对于WT的体外活性为<0.4的任何等位基因),则TNSALP残余活性为两个等位基因的平均活性。但是,如果等位基因1在其体外测定中显示DNE,则总活性估计为等位基因2的活性除以4(请参阅支持信息材料中的详细信息)。
至少没有在体外测试其ALPL变体之一的患者被视为缺少数据,因此被排除在进一步评估之外。
基于稳定性/亲和力变化的TNSALP同源性模型和变异评分
使用对应于人胎盘碱性磷酸酶的模板(PLAP; Le Du,Stigbrand,Taussig,Menez,&Stura,2001)构建人TNSALP的蛋白质同源性模型 。该模板与TNSALP的序列同一性为57%,X射线晶体结构分辨率为1.8Å。使用SchrödingerSuite蛋白制备向导为残留物扫描准备了结构(Sastry,Adzhigirey,Day,Annabhimoju和Sherman, 2013年)。每种可能的ALPL自动生成了missense变体,并使用分子力学/广义生表面积(MM / GBSA)方法预测了其对蛋白质稳定性和二聚体结合亲和力的影响,这是一种基于物理的方法,可根据预测到的变化对单残基突变进行评分蛋白质稳定性和结合亲和力(Beard,Choleti,Pearlman,Sherman和&Loving, 2013年)。有关TNSALP模型和残留物扫描软件构建的完整详细信息,
使用体外数据评估计算机算法的性能
使用体外活性值作为参考数据集,以评估(a)现有的计算机变异评分算法和(b)基于MM / GBSA稳定性/亲和力变化对变异进行评分的新方法的性能。在计算机方法的评估中,相对于野生型,“低”酶活性定义为≤0.25,相对于野生型,“高”酶活性定义为≥0.5。这些活性在这些阈值之间的变异体被排除在进一步评估之外,因为它们的活性范围使其致病性难以确定。
探索了一种新方法,其中将蛋白质稳定性算法得分与现有的计算机模拟算法得分相结合以改善总体变体分类。对于特定的ALPL变体或等位基因a i,如果变体活性低,我们首先将e(a i)表示为1,否则为0。基于蛋白质稳定性的估计量采用以下形式:
在该方程中,Ť 小号 =稳定性评分阈值,高于该Δ 小号(一个我)被认为是致病的,并且Ť 一个 =亲和力评分阈值,高于该Δ 一个(一个我)被认为是致病性的。
该估算器形式的背后原因是,如果一个变体的蛋白质稳定性或结合亲和力发生很大变化(估算器产生的值e(a i)= 1),则其酶活性可能很低,因此,有害 但是,相反的情况(估算器得出的值e(a i)= 1)不一定正确,因为除蛋白质结构变化外,可能会导致变异活性较低。在这种情况下,无法得出有关变异致病性的结论,应该使用现有的计算机评分。尽管如此,通过将算法输出设置为max(),结构模型提供的分类可用于改善任何现有的计算机变量计分算法。e(a i),f(a i)),其中f(a i)是归一化为(0,1)的任何特定计算机分数。
为了确定AUC估计的可变性并评估inico软件之间性能差异的统计显着性,执行了经典的自举程序,方法是对数据进行替换采样,测量每种inico软件的结果AUC,并重复进行10,000次采样。
统计分析
所有统计测试均以R语言(R Core Team,2017)版本3.6.0执行。使用R包ggplot2版本3.1.1生成图。(Wickham, 2016年)。
变种命名法
人类基因组变异学会的建议用于标准化所有分析变异的命名法。用于指定ALPL变体的参考序列是编码区规范转录本的RefSeq序列NM_000478.6(与Ensembl序列ENST000000374840.8相同)。相对于由该转录物的翻译产生的氨基酸序列,指定了蛋白质变体(在NP_000469.3中指定)(与Ensembl序列ENSP00000363973.3相同)。
ALPL功能测定,残留TNSALP活性和DNE的存在
总体而言,分析的变体中有94%(146/155)是错义变体(表 1)。在这两个阈值之间,有58%(90/155)的变体显示残留活性≤0.25,34%(52/155)的显露活性≥0.5%,8%(13/155)的显露活性在这两个阈值之间(图 1)。正如预期的那样,LoF变体(即移码,框内缺失和无义)显示出零残留活性(相对于WT),而错义变体涵盖了可能的相对酶活性的整个范围(图 1)。
表1. 155个ALPL变体的 分子结果

帧内删除2(1.3)

图1
在图形查看器中打开PowerPoint
ALPL变体相对于野生型的残差活性(按变体类型)
仅在HPP患者中存在的变体比仅在gnomAD人群中的变体或gnomAD人群和HPP患者中的变体具有更低的残留酶活性(图 2)。在测试的所有变体中,有24个显示出DNE的存在(仅在HPP患者中有15个,在HPP患者和gnomAD人群中有8个,仅在gnomAD人群中有1个),有124个显示DNE不存在,其中定义了DNE的存在WT /突变体活性<0.4,而DNE的不存在定义为WT /突变体活性> 0.45。这些阈值说明了测量的可变性,并且与先前有关DNE分类的报告一致(Taillandier等人, 2018)。在表S1中提供了155种测定的变体的残留酶活性和DNE结果的完整列表。

图2
在图形查看器中打开PowerPoint
ALPL变体的残留活性表示为变种来源的野生型活性的一部分。p如果成对的Kruskal–Wallis非参数检验值低于显着性阈值,则会将其添加到每对组的顶部。gnomAD,基因组聚合数据库;HPP,低磷性
图 3a显示了所有测试的ALPL变体(包括突变质粒和50:50 WT:突变质粒共转染)的酶活性(相对于WT),按变体出现的蛋白质域分类(Silvent,Gasse,Mornet和Sire) , 2014年)。对突变残基值作为每个域的函数的分析表明,活性位点或附近,冠域和同二聚体界面与低TNSALP残余活性值密切相关(图 3b))。例如,位于活性位点或附近的测试变体中有94%(17/18)表现出较低的残留酶活性,而该区域之外的测试变体中有53%(73/137)显示出低的酶活性(奇数)比率:11.74;用于二进位比较的Fisher精确检验p = .003)。同样,在18个位于活性位点或附近的变体中,有10个显示DNE存在,而6个显示DNE不存在(两个不确定的结果)。相反,在位于该位点外部的137个变体中,有14个显示DNE存在(比值比:13.61; Fisher精确检验p = 8.5×10 -6)。
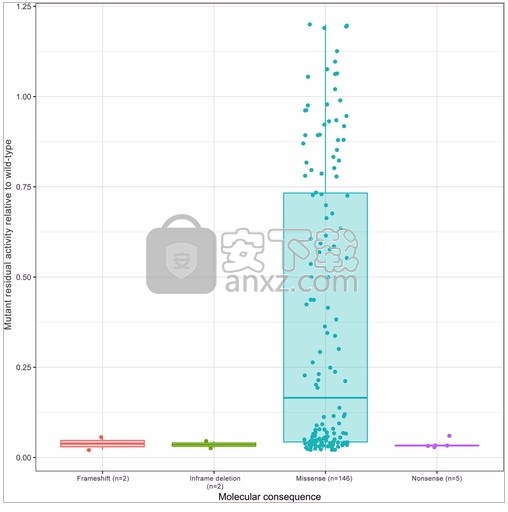
图3
在图形查看器中打开PowerPoint
相对于WT(a)的ALPL变体(突变质粒和50:50 WT:突变质粒共转染)的残留活性,以及相对于WT(b)的ALPL变体的残留活性的分数(按蛋白结构域位置分类)。每个突变体的cDNA均相对于标准RefSeq转录本NM_000478.6列出,并根据Silvent等人的描述和位置,根据其出现的蛋白质结构域进行着色。(2014)。p如果成对的Kruskal–Wallis非参数检验值低于显着性阈值,则会将其添加到每对组的顶部。cDNA,互补脱氧核糖核酸;TNSALP,组织非特异性碱性磷酸酶;WT,野生型
3.2患者特征和TNSALP活动
根据临床亚型对历史患者队列进行分类时,与其他亚型和总体队列相比,围产期致死和婴儿期HPP亚型患者的体外估计残留活性相对于WT明显降低(成对p <.01;图 4和表S2)。相比之下,儿童,成年和Odonto-HPP组之间的估计体外残留活性没有显着统计学差异(成对p > .25;未在图中显示)。
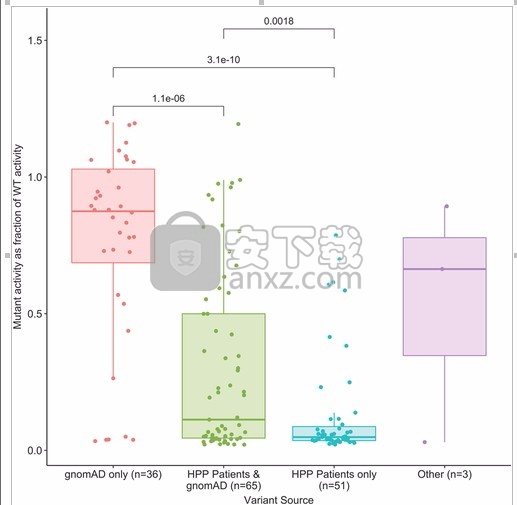
图4
在图形查看器中打开PowerPoint
HPP亚型相对于野生型的ALPL变体的残留活性。p如果成对的Kruskal–Wallis非参数检验值低于显着性阈值,则会将其添加到每对组的顶部。组织非特异性碱性磷酸酶基因ALPL ; HPP,低磷性
体外相对于WT残留活性ALPL变体(Ñ = 57)中,用ClinVar(兰德隆等人,重叠的 2018),通过报道的临床分类(不确定意义良性/可能是良性的,变体,和致病/可能致病归类)如图5所示 。如预期的,致病/可能致病的变体具有较低的残留酶活性。图 5还说明了相对于野生型的体外活性与群体中总gnomAD等位基因频率之间的关系。大多数评估的变体在人群中都很罕见,等位基因频率<10 -4不论残余酶活性水平如何;等位基因频率> 10 -3的更常见变体往往具有更高的残留酶活性。有趣的是,变体c.571G> A / p.Glu191Lys是仅有的具有低残留酶活性和gnomAD等位基因频率> 10 -3的一种。
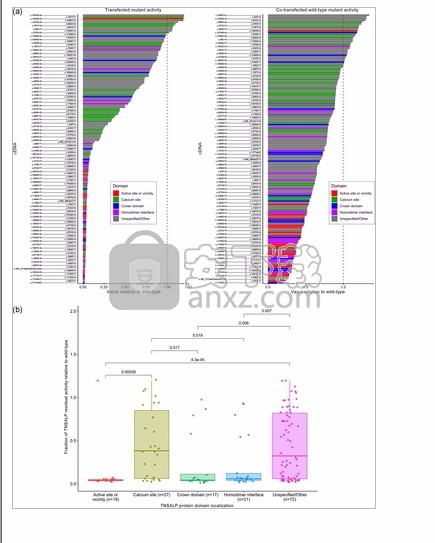
图5
在图形查看器中打开PowerPoint
基于ClinVar显着性(左)和gnomAD全球等位基因频率(右)的相对于野生型的残余活性分数。ALP,碱性磷酸酶;B,良性;gnomAD,基因组聚合数据库;LB,可能是良性的;LP,可能是致病的;P,致病性;TNSALP,组织非特异性碱性磷酸酶;VUS,意义不确定的变体
3.3蛋白质结构模型和TNSALP活性预测
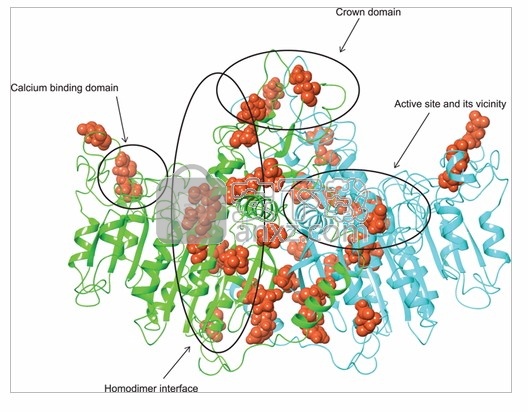
图 6显示了描绘为带状结构的TNSALP二聚体同源性模型,其中在体外实验中发现带有DNE的氨基酸位置以红色显示。尽管DNE变体出现在所有蛋白质结构域中,但 基于Silvent等人(1986年)描述的蛋白质结构域位置,同源二聚体界面富含DNE(奇数比:4.04; Fisher精确检验p = 0.0026)。(2014)。
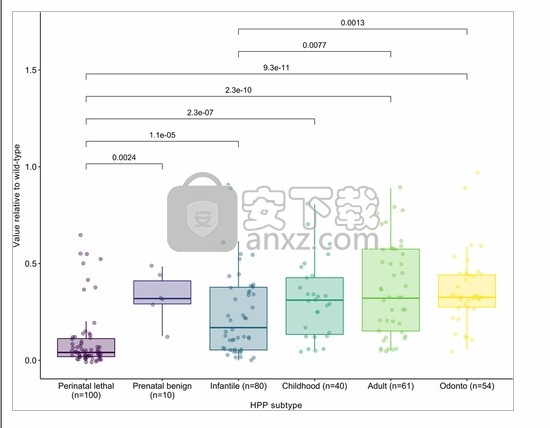
图6
在图形查看器中打开PowerPoint
DNE变体在TNSALP二聚体同源性模型的带状结构中的位置。发现显性-负性变异的位置显示为红色原子。相对链上的镜像残基没有箭头/圆圈标记。DNE,显性负效应;TNSALP,组织非特异性碱性磷酸酶
根据同源性模型,残基扫描过程中总共包含469个氨基酸位置,其中16个排除的位置侧链通过配位共价键与金属辅因子相互作用或存在二硫键,对所有19个可能的标准氨基酸变化进行评分,以产生总共8,911个突变体预测。所得到的Δ的完整列表小号,Δ 一,和Δ 最大值示于表S3。重要的是,在特定氨基酸位置上这种配位键的存在是变体酶活性被破坏的强烈预测因子。在这里分析的155个变体中,有16个处于这些交联位置,并且均显示出较低的酶活性(比值:无穷大; Fisher精确检验p = 0.001)。在这16个交联位置的测定变异中,有7个显示DNE,而134个非交联变异中有17个显示DNE(优势比:5.17; Fisher精确检验p = .005)。七个变体被排除在测试之外,因为它们显示出在低阈值和高阈值(如上定义)之间测得的DNE值。值得注意的是,在同源二聚体界面中显示DNE的变体的富集。而同型二聚体界面中的变体在低酶活性方面未显示出统计学上的显着富集(奇数比:2.26; Fisher精确检验p = .09),而对于DNE的存在,这些变体更加富集(奇数比:3.48; Fisher精确检验p = 0.017;图 6)。
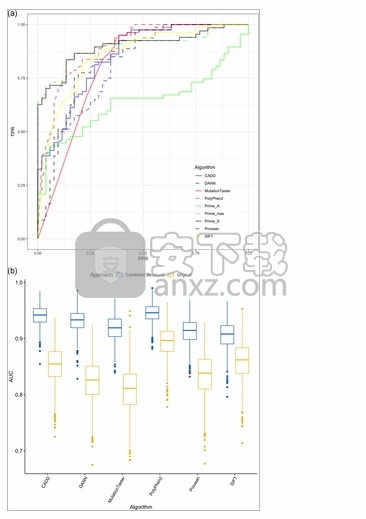
使用低/高酶活性分类作为参考数据,评估了六种计算机模拟算法(即CADD,DANN,MutationTaster,PolyPhen-2,PROVEAN和SIFT)以及基于蛋白质稳定性/亲和力的三种方法的ROC曲线测量值(即Prime_S,Prime_A和Prime_max)如图7a所示 ,基于稳定性变化的评分(Prime_S)达到了显着的正阳性率(0.63),同时将假阳性率保持在0,这要好得多比其他任何经过测试的方法都要好。综合得分(Prime_max)的表现略高于稳定性得分(Prime_S),而亲和力得分(Prime_A)表现最差。
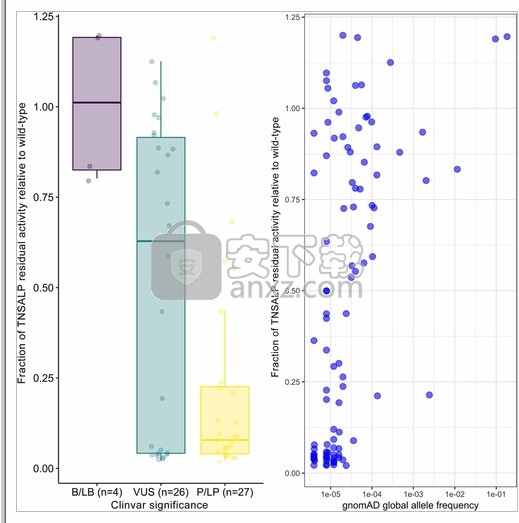
图7
在图形查看器中打开PowerPoint
ROC曲线显示了变体预测算法(a)的TPR与FPR,而in silico算法的引导AUC则是通过原始AUC值以及将silico分数与Δs相结合后获得的AUC和ROC值得出的(b)。AUC,ROC曲线下的面积;CADD,依赖于注释的组合注释;DANN,使用神经网络的遗传变异的有害注释;FPR,假阳性率;PROVEAN,蛋白质变异效应分析仪;ROC,接收机工作特性;SIFT,从容忍中排序不容忍;TPR,真阳性率;Δs ,通过计算预测的蛋白质稳定性变化
在这些数据的基础上,将来自计算机模拟算法的分数与基于稳定性分数(Prime_S)的预测相结合。图 7b显示了针对所有测试的六种算法获得的自举AUC,具有原始AUC值以及将计算机分数与稳定性分数预测结合后获得的AUC和ROC值。使用T s的阈值合并分数 = 36.9,这对应于Prime_S在假阳性率为0的情况下显示最高真实阳性率的阈值。使用组合方法导致AUC性能显着提高,达到0.945的平均值(95%置信区间) (0.907–0.976)与PolyPhen-2结合使用时,评估了现有的最佳计算机算法。表S4总结了AUC评分的平均值和95%置信区间。
在这项研究中,我们测试了155个ALPL变体,扩大了表征残留酶活性的ALPL变体的目录。功能测试不仅针对HPP患者的变异体进行,而且还针对普通人群的变异体进行,从而可以进行更全面的分析。在许多以前未报道的变体中发现了低残留活性和/或DNE。
总体而言,有94%的分析变体是错义的。其余为LoF(即移码,帧内删除和废话)。不出所料,仅在HPP患者而不是gnomAD人群中存在的变体(即稀有变体)比总gnomAD人群中的变体或HPP患者和gnomAD人群中的变体具有更低的残留酶活性。这与保持较低酶促活性的变体到较低群体频率的进化压力是一致的。变体c.571G> A / p.Glu191Lys是一个明显的异常值,在HPP患者和gnomAD人群中都相对较高,而残留酶活性为0.214,接近低活性阈值0.25。这是唯一分类为具有低活性且gnomAD等位基因频率> 10的变体-3(图 5b)。已知该变异体是欧洲血统HPP患者中最常见的变异体,先前报道的HPP队列中的等位基因频率为0.08,其中包括婴儿,儿童和Odonto-HPP患者(Whyte et al。,2015)。 本文分析的HPP队列中的等位基因频率为0.09。但是,此变体极有可能无法完全渗透,如gnomAD版本2.1拥有五个纯合的,大概是健康的受试者这一事实所说明的,在该数据集中,此变体的携带频率达到芬兰人口的> 3% (Karczewski et al。, 2019)。最后,应该指出的是,在特定人群中发现某些变体的频率更高。例如,在我们的分析中,变体c.1001G> A / p.Gly334Asp仅存在于HPP患者中(表S1),但在马尼托巴门诺石人群中的携带者频率估计为1/25(Greenberg等, 1990)。
残余酶活性与每个蛋白结构域的关系分析表明,活性位点,冠结构域和同型二聚体界面与低TNSALP残余活性密切相关。该发现与先前的发现一致,即与严重疾病相关的致病变体通常发生在这三个位点附近,这是TNSALP的关键功能域(Mornet等, 2001)。先前的报告还指出,与严重疾病相关的变异体位于钙结合位点(Brun-Heath,Taillandier,Serre和&Mornet, 2005; Mornet等, 2001)。)。有趣的是,在我们的分析中,该位点的TNSALP残留活性范围很广,该域中没有低酶活性变体的大量富集。因此,该结构域的变异致病性可能取决于其他因素,例如涉及的特定氨基酸变化和更详细的位置相互作用。此外,我们的分析发现,尽管具有DNE的变体遍布所有蛋白质结构域,但TNSALP同型二聚体界面以及活性位点或附近区域都富含DNE的变体。这与以前的分析一致,该分析发现大多数DNE变异体位于活性位点或其附近,冠结构域或同二聚体界面(Fauvert等, 2009 ; Taillandier等, 2018)。)。
酶活性严重降低的变体在HPP群体中的频率往往很低,这与HPP的稀有性相一致,尤其是在其围产期和婴儿期(Mornet,Yvard,Taillandier,Fauvert和Simon-Bouy, 2011)。有趣的是,尽管低的残留活性预示着致病性,但事实并非如此,较高的残留活性值并不一定排除变异体具有致病性。在两个实例中观察到了这一点。首先,当预测HPP队列中的残留活性时,我们发现非常低的体外值几乎完全与围产期致死或婴儿期HPP相关(图 4)。但是,在HPP亚型中,预计的体外活性存在重大重叠。此外,HPP患者的活动水平与理论上与健康携带者相对应的活动水平之间存在重叠(≥50%)。因此,体外TNSALP酶活性低的预测值限于与最严重的HPP亚型相关的非常低的值。其次,将变体的体外残留活性与ClinVar的临床意义联系起来时,也观察到了类似的观察结果(Landrum et al。, 2018)。尽管我们在病原体/可能的病原体变体分类中观察到了预期的低酶活性值浓度,但更高的活性值(> WT参考值的50%)可能与任何临床意义相关(图 5))。重要的是要注意,仅通过收集更多变体的体外数据,仅基于ALPL变体信息对较轻型HPP亚型(例如,围产期良性,童年,成人,齿形畸形)的准确预测可能不会得到改善。即使在具有相同ALPL变异的家庭成员之间,患者之间也存在显着的临床异质性(Hofmann等, 2014; Stevenson等, 2008)。这表明其他基因以及表观遗传或环境因素可能对HPP表型有影响(Mornet, 2018)。因此,将需要更好地了解其他基因如何与TNSALP相互作用以及它们如何修饰TNSALP表达和活性,以改善临床亚型预测。
总的来说,这些观察结果强调了HPP的遗传复杂性,并支持将变异体分类为潜在的致病性,如果其体外残留活性较低。这与已发表的文献一致(Mornet,2015;Zurutuza 等, 1999),在该文献中,残留酶促TNSALP活性的极低值与更严重的HPP临床表现有关(例如,围产期致死,婴儿)。相反,更高频率的ALPL变体以及ClinVar中分类的变体(Landrum等, 为“良性”或“可能是良性的”,其残留的酶活性接近野生型参考值。但是,相对于野生型而言,高残留酶活性值并不一定能排除HPP,因为酶活性的降低可能不是遗传变异导致该病的唯一致病机制。具体而言,已经提出,患有严重疾病的患者中的特定等位基因可能不会降低酶的活性,而是会通过其他机制(例如破坏TNSALP二聚体的锚定,转运和在细胞外结构域中的定位或破坏其产生)破坏正常功能。在蛋白酶体中未正确降解的聚集体的数量(Brun-Heath等,
我们计算了六种计算机模拟变异预测算法(即CADD,DANN,MutationTaster,PolyPhen-2,PROVEAN和SIFT)以及三种基于蛋白质稳定性/亲和力测量值(Prime_S,Prime_A和Prime_max)的ROC曲线。Prime_S方法提供了最佳结果,其真阳性率为0.63,而假阳性率为0。此外,Prime_S本身显示了所有评估计算方法中的最佳平均AUC(图 7和表S4) 。这些结果表明Prime_S本身就是最具体的ALPL测试过的变异致病性预测因子,并且对于所有测试的变异,如果Prime_S将变异标记为潜在致病性,则该预测很可能是正确的。重要的是,我们展示了一种简单的方法,可以将现有计算机软件中的分数与基于稳定性分数(Prime_S)的预测相结合,从而进一步提高估计的残留TNSALP酶活性的性能分数。据我们所知,该组合预测因子是迄今为止发布的ALPL变异致病性的最佳计算预测因子。
我们的研究有几项局限。我们的分析基于人胎盘ALP的同源性模型,而不是TNSALP的直接3D结构模型。但是,所选择的模板具有高分辨率(1.8Å)的X射线晶体结构,并且与TNSALP的序列相同(57%;支持信息材料)。因此,我们相信,只有高分辨率TNSALP结构模型可用时,用于此分析的计算方法才会进一步改善。本研究并非旨在捕获ALPL变体可能会致病的机制,而不是破坏TNSALP酶活性。关于复合杂合患者的TNSALP残留活性的估计,这是根据是否存在DNE确定的,如本节所述。 2.4和支持性信息材料。原则上,更好的方法是产生突变体/突变体混合物并测量其活性。但是,这种方法的可行性在实践中受到限制,因为它将需要测试所有可能的变体配对(例如,对于100个变体配对,将需要进行大约5,000次测试)。此外,用于体外变体表征的基于质粒的技术无法评估非外显子变体的致病性,例如剪接,内含子或5'/ 3'非翻译区的变体,这是一个复杂且昂贵的过程,难以扩展评估报告的ALPL变体的数量不断增加。ALPL的计算评分基于蛋白质稳定性变化的变异体将来也可以改进,例如通过使用自由能扰动方法(Ford&Babaoglu, 2017; Steinbrecher,Abel,Clark和&Friesner, 2017),其可以模拟蛋白质的变化。骨架的柔韧性以及明显的溶剂化作用。此外,尽管这项研究的计算方面的重点是预测低残留酶活性,但应做进一步的研究以改进对变异株的DNE的预测。
共有155种ALPL变体在普通人群和HPP患者中进行了检测,从而扩大了已知ALPL的目录体外功能变异。观察到残留酶活性与变体来源,变体类型,受影响的蛋白结构域和HPP亚型之间的关联(仅就围产期/婴儿与其他方面而言;估计的体外残留活性之间无显着统计学差异)儿童,成人和Odonto-HPP组)。我们描述了一种将结构模型预测与现有的计算机模拟算法相结合的方法,该算法提高了性能分数以估计残留的TNSALP酶活性。重要的是,这项研究证实了较低的体外残留活性支持将变体归类为潜在的致病原因。然而,低体外TNSALP酶活性的预测价值仅限于与最严重的HPP亚型(围产期和婴儿期HPP)相关的极低值。尽管很明显,不能单独使用TNSALP酶活性来评估HPP疾病的严重程度,但该工具与临床评估相结合将进一步加深我们对HPP表型谱的了解。
人气软件
-

南方cass 65.9 MB
/简体中文 -

迈迪工具集 211.0 MB
/简体中文 -

origin(函数绘图工具) 88.0 MB
/简体中文 -

OriginLab OriginPro2018中文 493.0 MB
/简体中文 -

探索者TssD2017 417.0 MB
/简体中文 -

mapgis10.3中文(数据收集与管理工具) 168.66 MB
/简体中文 -

刻绘大师绿色版 8.32 MB
/简体中文 -

SigmaPlot 119 MB
/简体中文 -

keyshot6 1024 MB
/简体中文 -

Matlab 2016b 8376 MB
/简体中文


 女娲设计器(GEditor) v3.0.0.1 绿色版
女娲设计器(GEditor) v3.0.0.1 绿色版  iMindQ(思维导图软件) v8.1.2 中文
iMindQ(思维导图软件) v8.1.2 中文  Altair Embed(嵌入式系统开发工具) v2019.01 附带安装教程
Altair Embed(嵌入式系统开发工具) v2019.01 附带安装教程  avizo 2019.1(avizo三维可视化软件) 附安装教程
avizo 2019.1(avizo三维可视化软件) 附安装教程  ChemOffice 2017 附带安装教程
ChemOffice 2017 附带安装教程  绘图助手 v1.0
绘图助手 v1.0 











